Naukowcy ze Szkoły Głównej Gospodarstwa Wiejskiego w Warszawie we współpracy z naukowcami z University of Texas Southwestern Medical Center z Dallas w USA oraz z Instytutem Biochemii i Biofizyki Polskiej Akademii Nauk odkryli i przebadali nieznane dotąd białko efektorowe – istotne dla organizmów żywych. O osiągnięciu przeczytać można w prestiżowym dla biologów czasopiśmie „Cell”.
Studencki początek
Wszystko zaczęło się ok. 4 lata temu, kiedy to Marcin Gradowski – obecnie doktorant dr. hab. Krzysztofa Pawłowskiego z Katedry Biochemii i Mikrobiologii Instytutu Biologii SGGW – w ramach pracy magisterskiej poszukiwał kinaz efektorowych wśród Gammaproteobakterii. Trafił wtedy na białko efektorowe HopBF1 z Pseudomonas syringae (patogen roślin), które było w niewielkim stopniu podobne do znanych kinaz. Dr hab. Krzysztof Pawłowski – promotor pracy magisterskiej M. Gradowskiego – pokazał odkryte białko dr. Vincentowi Tagliabracciemu z University of Texas Southwestern Medical. To właśnie on wraz z zespołem prof. dr. hab. Jacka Henninga z Instytutu Biochemii i Biofizyki Polskiej Akademii Nauk rozwinął projekt badawczy białka.
W wyniku współpracy pojawiły się ciekawe wyniki, które zostały opisane i opublikowane w prestiżowym dla biologów czasopiśmie „Cell” w artykule pt. A Bacterial Effector Mimics a Host HSP90 Client to Undermine Immunity. Głównymi autorami pracy są dr Vincent Tagliabracci oraz jego doktoranci – Victor Lopez i Brenden Park. Współautorami są dr hab. Krzysztof Pawłowski oraz Marcin Gradowski. Dużą rolę w badaniach odegrał też zespół prof. J. Henninga.
Białko efektorowe HopBF1
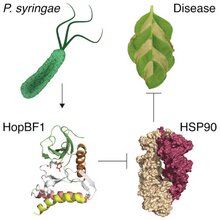
Pseudomonas syringae to bakteria patogenna roślin, która stosuje białka efektorowe, aby „namieszać” w komórkach gospodarza na swoją korzyść. Odkryte przez naukowców białko faktycznie okazało się kinazą białkową (HopBF1), ale o minimalnie zachowanej strukturze kinazy. HopBF1 wpuszczone w ciało komórki gospodarza oddziałuje na białko opiekuńcze HSP90 – udaje jego białko („klienta”). Białka opiekuńcze wspomagają proces samodzielnego fałdowania się – kształtowania kilku białek (m.in. kinaz białkowych lub receptorów wrodzonej odporności). Zapobiegają tworzeniu się nieprawidłowych wiązań.
HSP90 jest niezbędnym składnikiem odporności roślin i zwierząt, a patogenne strategie bezpośrednio ukierunkowane na to białko nie zostały dotąd opisane – wyjaśnia Marcin Gradowski. – HopBF1 przyjmuje minimalnie rozpoznawalne przez HSP90 gospodarza fałdowanie (strukturę) kinazy białkowej. W rezultacie HopBF1 „zdradziecko” fosforyluje HSP90 (przyłącza fosforan), aby całkowicie zahamować jego aktywność. Skutkiem tego jest zhamowanie aktywacji receptorów odporności, które wyzwalają reakcje nadwrażliwości HR (ang. hypersensitive response) u roślin. Jest to mechanizm wykorzystywany przez rośliny w celu uniknięcia rozprzestrzeniania się zakażenia. Polega na szybkim obumieraniu zainfekowanych i sąsiadujących z nimi komórek, czego efektem jest zatrzymanie rozprzestrzenienia się patogenu. Zależna od HopBF1 fosforylacja HSP90 jest wystarczająca do indukcji ciężkich objawów chorobowych (m.in. obumierania tkanek liści) u roślin zakażonych tym patogenem. Należy nadmienić, że bakteria nie fosforyluje bakteryjnych białek HSP90 in vitro. W naszych badaniach HopBF1 oddziaływało też na HSP90 drożdży, co skutkowało zahamowaniem wzrostu.
Co dalej?
Odkryta przez naukowców kinaza efektorowa ujawnia uprzednio nierozpoznany „zdradziecki” mechanizm, przez który patogeny bakteryjne modulują odporność gospodarza. Poznanie tego mechanizmu może dać możliwość leczenia nowotworów. Za pomocą HopBF1 można by było zablokować białka HSP90, które promują wzrost i przetrwanie wielu komórek nowotworowych. Do tego potrzeba jeszcze wielu badań, ale odkrycie daje nadzieję na walkę z nowotworami i innymi chorobami u ludzi np. z chorobą Alzheimera.
Jeżeli chodzi o rośliny, to możemy tworzyć inhibitory, czyli inaczej blokery kinazy HopBF1, ponieważ jest ona ważnym czynnikiem wirulencji bakterii – mówi M. Gradowski. – Jej działanie jest wystarczające do wywołania zmian chorobowych w organizmach żywych, m.in. do obumierania liści. A żeby ten proces zatrzymać, potrzebne jest zaprojektowanie specyficznych dla tej kinazy inhibitorów.
Takie inhibitory – sztuczne blokery – można by wykorzystać w praktyce jako nowy środek ochrony roślin. Być może rozprzestrzenianie się niektórych chorób nie byłoby już aż tak problematyczne.
Anita Kruk, Biuro Promocji SGGW
Konsultacja merytoryczna: mgr Marcin Gradowski, doktorant w Katedrze Biochemii i Mikrobiologii Instytutu Biologii SGGW