Międzynarodowy zespół badawczy, do którego należą naukowcy ze Szkoły Głównej Gospodarstwa Wiejskiego w Warszawie, dokonał odkrycia, o którym usłyszał świat. Stało się to za sprawą publikacji wyników w prestiżowym dla biologów czasopiśmie „Cell”. Naukowcy odnaleźli i przebadali tajemnicze białko, które okazało się być niezwykle ważne dla większości organizmów żywych.
Każdy organizm składa się z tysięcy różnych białek, które są mu niezbędne do życia. Na przykład, człowiek ma ich ponad 20 tys. Jedna czwarta z nich nie została jeszcze przebadana, więc nie wiemy do czego służą. Zapewne nie prędko się dowiemy. Badania zupełnie nieznanych dotąd białek są bardzo ryzykowne i trudno zdobyć na nie fundusze. Istnieje ryzyko, że włożona praca i zainwestowane pieniądze nie przyczynią się do żadnego odkrycia. Dr hab. Krzysztof Pawłowski z Katedry Doświadczalnictwa i Bioinformatyki Wydziału Rolnictwa i Biologii Szkoły Głównej Gospodarstwa Wiejskiego w Warszawie zaryzykował i odniósł sukces! Polskiemu zespołowi badawczemu, którym kierował, udało się zdobyć grant na badania nieznanego dotąd białka. W skład zespołu weszła doktorantka Monika Karasiewicz-Urbańska z Samodzielnego Zakładu Biologii Mikroorganizmów Wydziału Rolnictwa i Biologii SGGW, dr hab. Róża Kucharczyk z Instytutu Biochemii i Biofizyki PAN, dr hab. Małgorzata Łobocka z Samodzielnego Zakładu Biologii Mikroorganizmów Wydziału Rolnictwa i Biologii SGGW oraz z Instytutu Biochemii i Biofizyki PAN, a także doktorantka Sylwia Pilch z Instytutu Biochemii i Biofizyki PAN. Nieznane białko odkrył właśnie zespół dr. hab. Krzysztofa Pawłowskiego. Następnie powstał międzynarodowy zespół badawczy połączony z dwóch – polskiego i amerykańskiego, który zajął się badaniem nowoodkrytego białka. Zespołem amerykańskim kierował dr Vincent Tagliabracci z University of Texas Southwestern Medical Center z Dallas w USA i to on jest głównym autorem publikacji w czasopiśmie „Cell”.
Odkrycie białka
Od czego wszystko się zaczęło? Od obserwacji sekwencji białek, czyli ciągu reszt aminokwasowych. Białko to długi łańcuch, który może przyjmować różne kształty. Najczęściej jego kształt kojarzy się ze skręconą serpentyną, ale w rzeczywistości jest znacznie bardziej skomplikowany. Od zawartych w nim aminokwasów i kolejności ich ułożenia zależy to, w jakiego rodzaju „kłębek” białko się zwinie i w jaki sposób będzie działać.
- „Żeby ułatwić sobie myślenie o białkach, zapisuje się je w postaci ciągu liter, dlatego że aminokwasów w białkach występuje ok. 20” – wyjaśnia dr hab. Krzysztof Pawłowski. – „Każdemu z nich można przyporządkować inną literę. Ciąg aminokwasów w łańcuchu to ciąg liter. W przeciętnym białku tych liter będzie od kilkudziesięciu w najkrótszych białkach do kilku tysięcy – w najdłuższych. Co ciekawe, początki nowych odkryć w biologii białek często rodzą się od „patrzenia” na te długie ciągi liter”. –
Efektem „obserwacji” ciągów liter prowadzonej metodami bioinformatyki było odkrycie ciekawych własności zupełnie nieznanej dotąd rodziny – selenobiałek O (selO).
- „Zaobserwowałem kilka rzeczy” – tłumaczy dr hab. Krzysztof Pawłowski. – „Po pierwsze jest to białko, które bardzo mało zmieniło się, odkąd na ziemi żyli przodkowie ludzi, grzybów, pierwotniaków, bakterii, czyli od bardzo, bardzo dawna. To się dość rzadko zdarza. Zwykle białka zmieniają się w toku ewolucji na tyle mocno, że znalezienie podobieństw jest trudne. Natomiast, jeżeli podobieństwo jest duże, to naturalny wniosek jest taki, że jest to coś bardzo ważnego dla organizmu. Musiały więc być istotne powody, by takie ważne i doskonałe narzędzie nie przekształciło się znacznie w toku ewolucji.”
To był pierwszy powód, żeby zająć się badaniem tajemniczego białka i odkryć, dlaczego jest ono tak istotne.
- „Po drugie, selen jest dość rzadkim pierwiastkiem” – dodaje. – „Dla organizmu zbudowanie selenobiałka jest kosztowną „inwestycją”. Łatwiej zrobić białko bez selenu. Człowiek ma ponad 20 tys. białek, zaledwie nieco ponad 20 z nich to selenobiałka. Kosztowne rzeczy wykorzystujemy do specjalnych celów. Ponadto znalazłem podobieństwo ewolucyjne SelO do kinaz, czyli bardzo ważnych enzymów wykorzystywanych w sygnalizacji komórkowej, które włączają i wyłączają różne procesy. Fakt, że odkryte białko to selenobiałko i przypuszczalnie kinaza, która dobrze zachowała się w czasie ewolucji, jeszcze bardziej zasugerowało, że to jest ważny obiekt. Z różnych bioinformatycznych rozważań wysnuliśmy przypuszczenie, że to białko jest aktywne w odpowiedzi na tzw. stres oksydacyjny, czyli pomaga w odpowiednim reagowaniu na trudne warunki środowiska związane ze szkodliwym działaniem reaktywnych form tlenu”.
Odporność na stres oksydacyjny
Żeby potwierdzić swoje przypuszczenia, naukowcy przeprowadzili eksperyment z wykorzystaniem bakterii Escherichia coli. Do kropli roztworu, w którym były bakterie, dodano silny środek dezynfekcyjny – wodę utlenioną. Po jakimś czasie pojawiły się bąbelki, ponieważ bakterie „źle się czuły” w tym roztworze i zaczęły rozkładać wodę utlenioną. W tym celu bakterie E. coli włączały różne enzymy umożliwiające złagodzenie efektów tej śmiercionośnej substancji. Kiedy metodą inżynierii genetycznej zmodyfikowano szczep bakterii przez wyłączenie genu SelO, okazało się, że tak upośledzone bakterie gorzej sobie radziły – pojawiło się dużo mniej bąbelków. Eksperyment wykazał, że gen selO wpływa na zdolność organizmu do radzenia sobie ze stresem oksydacyjnym.
Jednak nie kinaza?
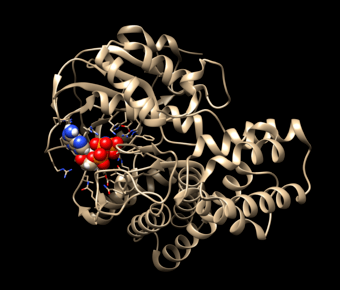
W następnej kolejności należało sprawdzić jak to nieznane białko działa. Tu zasadniczą rolę odegrał zespół dr. Vincenta Tagliabracci, który wyznaczył trójwymiarową strukturę białka SelO. Najpierw uzyskał kryształ badanego białka, a następnie rozpraszał na nim promienie Roentgena. W ten sposób uzyskał obraz dyfrakcyjny i odtworzył położenie każdego atomu białka. Wiedza ta oznacza dokładne poznanie budowy białka i znacznie ułatwia zrozumienie jego funkcji.
Wynik badania zaskoczył naukowców. Okazało się, że struktura białka jest rzeczywiście podobna do kinazy, ale na obrazie cząsteczka ATP (adenozynotrójfosforanu), którego kinaza używa do fosforylacji, jest związana z białkiem SelO w bardzo nietypowy sposób. Wywnioskowano stąd, a następnie wykazano biochemicznie, że tajemnicze białko SelO AMPyluje inne białka, czyli dołącza do nich AMP (adenozynomonofosforan), regulując w ten sposób ich działanie. Oznacza to, że SelO jest AMPylazą.
- „Wynik ten jest sporą sensacją. O ile kinaz u człowieka jest ponad pięćset, o tyle AMPylaza była dotąd znana tylko jedna. Ta odkryta przez nas jest drugą. Do tego jest ona bardzo dobrze zachowana pod względem ewolucyjnym. Pokazaliśmy, że rzeczywiście AMPylacja oznacza „doczepianie” do innych białek reszty AMP i potrzebna jest do regulowania odpowiedzi na stres oksydacyjny. Tego właśnie dotyczył nasz artykuł w „Cell”, ale nasze odkrycie otwiera bardzo dużo różnych nowych tematów badawczych” – podsumował dr hab. Krzysztof Pawłowski.
Materiał opracowała: Anita Kruk, Biuro Promocji SGGW
Konsultacja merytoryczna: dr hab. Krzysztof Pawłowski, Katedra Doświadczalnictwa i Bioinformatyki Wydziału Rolnictwa i Biologii SGGW